HOME ���� �Z�p��� ���� �����Ƃ� - �����̌����Ə������u
�����̌����Ə������u
�����̌����Ə������u
�������̏��C���Ɖ��x�̊W�A�t���Z�x�ƋC���Z�x�̊W�i�C�t���t�j�𗝉����A���C���̑傫���i���_���Ⴂ�j�������C���ł��Z�x�������Ȃ邱�Ƃ𗝉����܂����B �������A�P�����i�����j�݂̂ł́A���̕����̒��x�͕s�\���ł����B �ŁA�����ƔZ�x���グ��ɂ͂ǂ�����悢�����l���Ă݂܂��傤�B
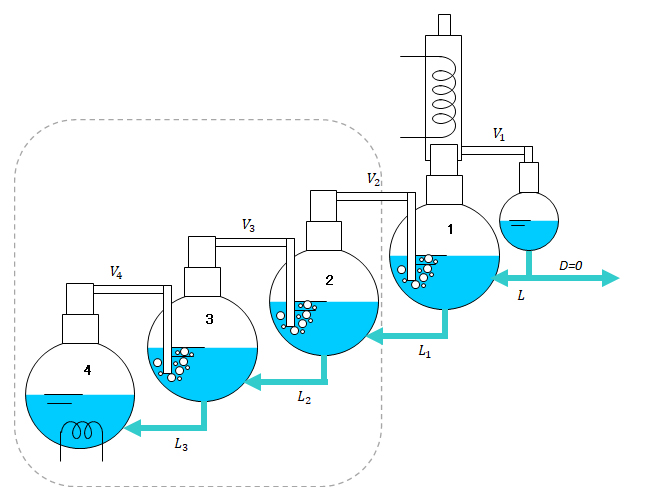
1��̏����ł́A���Ƃ��A�x���[��-�L�V�����n�������x�ł����B ���̓���ꂽ�t���ēx����������ƁA�ƂȂ�A���̉t���ēx����������ƁA�ƂȂ�B ���̑�����J��Ԃ��ƌ���Ȃ����������ɋ߂Â������ł��B ���̗l�q��}-12�Ɏ����܂��B
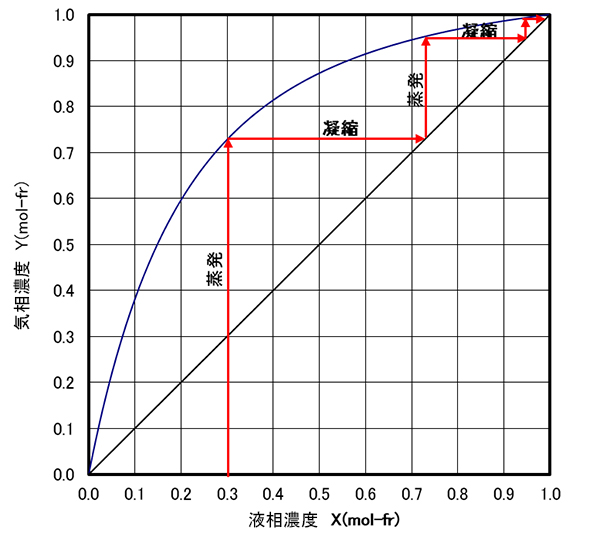
�����A�Ïk�̌J��Ԃ��A�Ƃ͋�̓I�ɂǂ̂悤�ɂ���̂���}-13�Ŏ����܂��B�e�t���X�R�ɂ̓q�[�^�����t�����Ă��ĉt�͕������Ă��ăR���f���T�[�ŋÏk���A���̃t���X�R�Ɉڂ����B�������Ă���ƃt���X�R���̉t���Ȃ��Ȃ�܂��B�����h�����߁A��ԉE�̃t���X�R���珇���t��߂��܂��B���̌��ʁA�}-12�Ɏ����ꂽ�悤�Ƀt���X�R���̉t�͉E�ɍs���ɂ��������ď����Z�x���オ������ԂƂȂ�܂��B
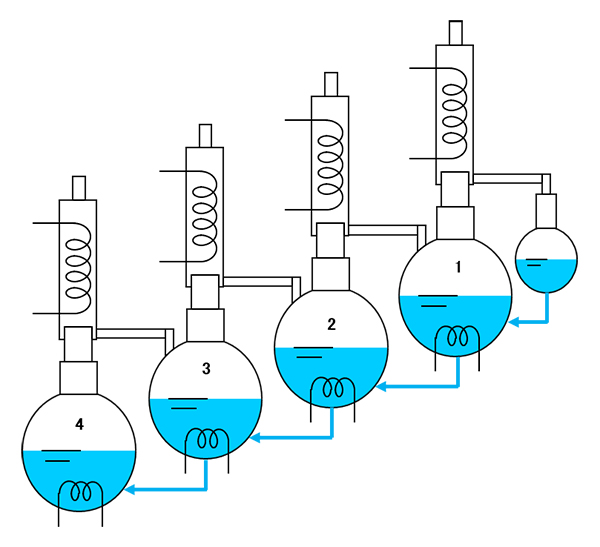
�}-13�ł́A�e�t���X�R�Ƀq�[�^�[�ƃR���f���T�[���t���Ă��܂����A���}�A�}-14�̂悤�ɍH�v���Ă݂܂��傤�B
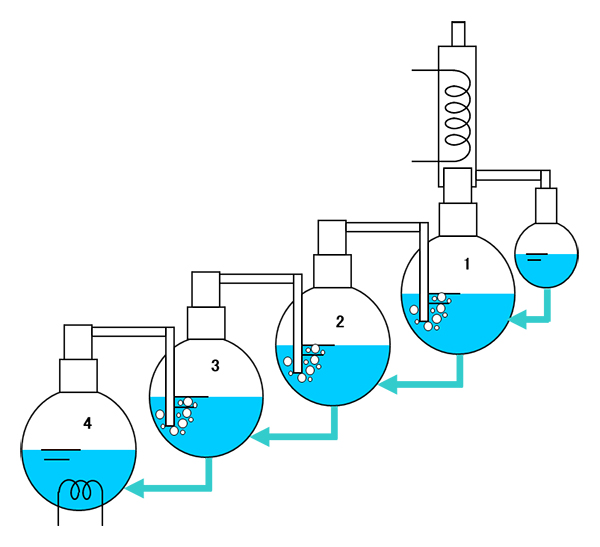
�}-14�́A�q�[�^�[�́A�ʼn��i�݂̂ŃR���f���T�[�͍ŏ�i�̂݁B4�̃t���X�R�Ŕ����������C�͂��̂܂�3�̃t���X�R�ɓ���A3�̃t���X�R�̔M���ƂȂ�B�����āA�����ŏ�i�ɑ����āA�ŏ�i�ł̂݃R���f���T�[�ŋÏk������B���̂悤�ɔM�ړ��ƕ����ړ����ɍs���鑀�삪��������ł��B
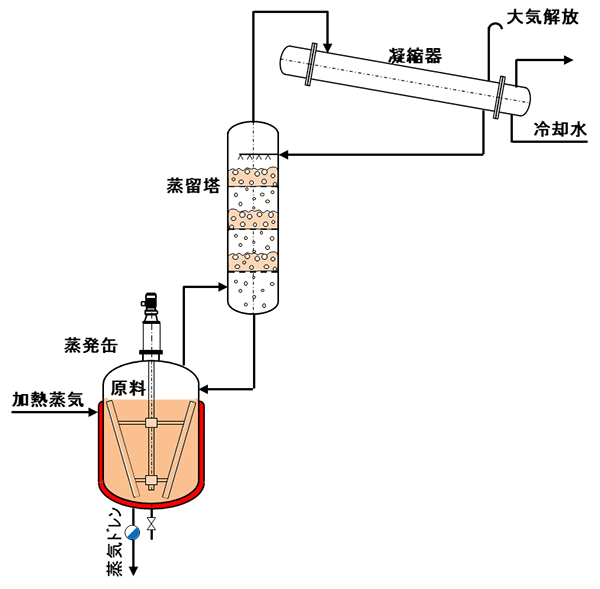
���̑��삪���������H�v����Đ}-15�̂悤�ȑ��u�ƂȂ�A���ꂪ�������Ƃ����Ă��鑕�u�ł��B�������́A�}-10 �������u�@�̏����ʂƃR���f���T�[�̊Ԃɔz�u����邱�ƂɂȂ�܂��B
���������g�p����ƁA�y�������̔Z�x������Ȃ����������ɋ߂Â����邱�Ƃ𗝉����܂����B �������A�}-13�`�}15�ł͔Z���Ȃ����y�������o���Ă��܂���B�Z�k���ꂽ��Ԃ��`�����ꂽ�ɉ߂��܂���B �����ŋÏk���ꂽ�Z�k�t�����o���ɂ͕������x�������ɉ����Ȃ���Ȃ�܂���B
�������ƕ������x
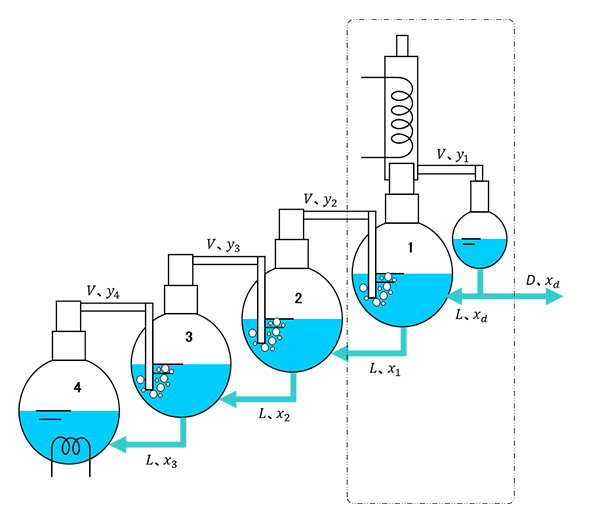
�}-16�͐}14�̍Čf�ł��B���炭�A���̃t���X�R�}�ŕ������x���l���܂��B�t���X�R4�̃q�[�^�[���̏��C���������Ƃ��A���̑��̃t���X�R���甭��������C�͂ǂ��Ȃ邩�H�@���������M�͖������܂��B�e�t���X�R�͏㕔�ɂȂ�قlj��x�͉�����܂��B���̉��x�����������邱�Ƃɂ��܂��B �����āA�����ł�����傫�ȉ�������܂��B�e�t���X�R�Ŕ���������C���ʂ͂��ׂē������i�e�i�̏������M�͓������Ƃ��܂��j�B�܂��u����������v�Ƃ��܂��B
����̕����̃����������M�́A���L�̂Ƃ���ł��B
- �x���[��
- 30.78
- 7,353
- �g���G��
- 33.49
- 8,000
- o-�L�V����
- 36.84
- 8,800
- ��
- 40.77
- 9,740
- ���^�m�[��
- 35.25
- 8,420
- �G�^�m�[��
- 39.35
- 9,400
- MEK
(���`���G�`���P�g��) - 31.98
- 7,639
������Ƒ�_�ł͂���܂����A���悻�������Ƃ����Γ������C�����܂��B ���̂悤�ɉ��肷��ƁA�������x������߂ĒP��������܂��B
�}-16���ł̏�Ԃœ_���l�p�ň͂܂ꂽ�����̕������x���Ƃ�܂��B�t���Z�x���A�C���Z�x���Ƃ��܂��B�_���l�p�ň͂܂ꂽ��������o�Ă䂭���ʂ��A�����Ă��鑍�ʂ��ł��B����(1)�Ɋւ��ẮA�o�Ă䂭�ʂ��A�����Ă���ʂ��ł��B
����������
���̋��ł������悤�Ȏ��ɂȂ�̂ŁA�����ƂȂ�B
(27)���́A�i�S�җ��Ƃ����j�ł�����ł���̂ŁA�}-17���̐��i�Ίp���j�ł��邱�Ƃ��킩��܂��B���̐��𑀍���i�������x���j�Ƃ�т܂��B
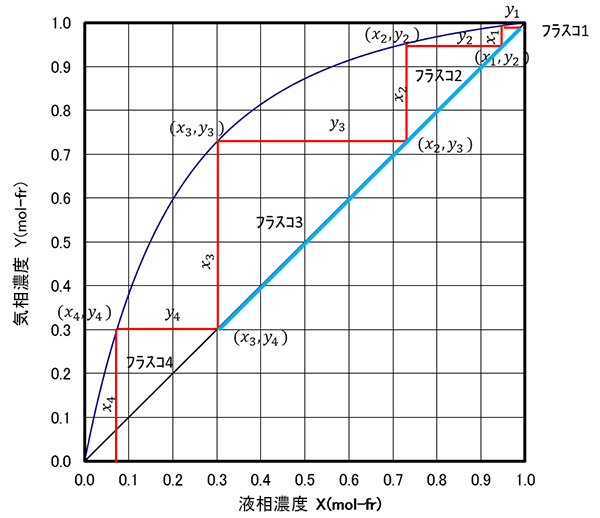
�}-18�Ŋe�t���X�R����ł���C���ʂ���ъe�t���X�R����߂�t�ʂ͓�����(����������)�Ƃ��āA���o�����ʂ��Ƃ��āA��_�����ň͂܂ꂽ�����ŕ������x���Ƃ�ƁA
�����āA���i28�j�Ɠ��l�ȕ������x���e�t���X�R�Ő��藧���܂��̂ŁA����������
�Ȃ鎮�����o����܂��B ���̎��́A�������t�Z�x�Ƃ��A�c�����C���Z�x�Ƃ����Ƃ��A�����ƂȂ�A���̌X�����ŁA�ؕЂ��ƂȂ邱�Ƃ������Ă��܂��B �����āA���̎��͕������x���瓱���ꂽ���ŁA�e�i�̕������x�������Ă��܂��B�܂��A�͊җ����ƒ�`�����ŁA�ƒu���A�A�ƂȂ�A��(29)�̖����������ꂽ��(30)�܂��B
�������āA�}-15�������u�̐v���\�ƂȂ�܂����B ���̎菇��x-y���}��p���Đ������܂��B �}-19�ł��B
���_�i���Ɗҗ���
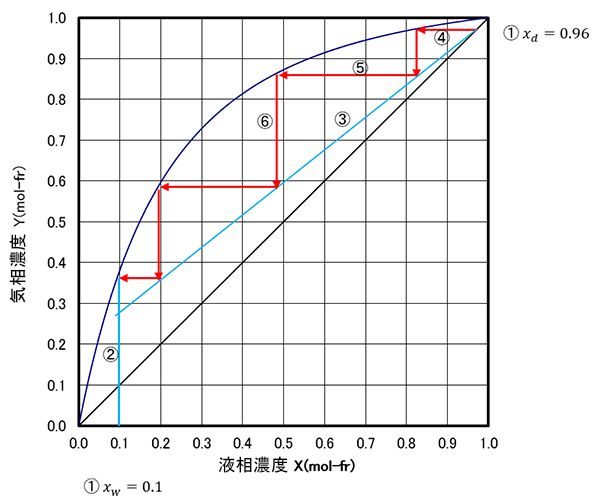
��(30)�ƋC�t���t���}��g�ݍ��킹��ƁA���́A���̂悤�ɊȕւȐ}��@�ŗ��_�i���Ɗҗ��䂪���܂�܂��B
- ���Ɏd���t�Z�x���Ƃ��A�������瓾�����t�Z�x���Ƃ��܂��B
- ����C�t���t����܂Ő����������܂��B
- �i��������̏��C�Z�x=�����������t�Z�x�ł��̂őΊp����ƂȂ�܂��j���玮(30)�ɑ������镨�����x��(������Ƃ��܂�)�������܂��B���̐����(�A)���œ_����邱�ƂɂȂ�܂��B
- �����A�����܂�܂��B�C�t���t���������܂�܂��B
- �ƕ������x���i������j�̌�_�����܂��B
- �C�t���t�����܂��B
���̂悤�ɁA�C�t���t���������x���C�t���t���������x ���J��Ԃ��Ċ��Ɏd���t�Z�x�܂ŊK�i��}��i�߂�̂ł��B �������̓����Z�x���z�͋C�t���t�݂̂Ō��܂�̂ł͂Ȃ��A�C�t���t�ƕ������x�̑g�ݍ��킹�Ō��܂邱�Ƃ𗝉����Ă��������B
(����) 3.�̕������x��(�����)�ɂ���ĕK�v�Ƃ��闝�_�i���ƕK�v�Ƃ��铃����C���ʁi�җ���j�����܂�܂��B���̌X����Ίp���ɋ߂Â���Ɨ��_�i���͏��Ȃ��Ȃ�܂��B���A�K�v�Ƃ��铃����C���ʂ͑����܂��B���̊W�����Ɏ����܂��B
�ŏ����_�i���ƍŏ��җ���
�}-16�ȍ~�A�e�i�Ɠ����Ƃ̕������x�̘b�����Ă��܂����B���S�̂̎��x�͎���Ă��܂���ł����B�������甲�����������͓���̉t���������A����̌y�����Z�x���������܂��B�������A���̂��Ƃ͂��炭�I�ɏグ�Ă����܂��B����̉t�͏\���ɑ�����������̔��o�ɂ͉e������Ȃ���Ԃł̘b�Ƃ��Ă����܂��傤�B �}-20�A21�����Ă��������B
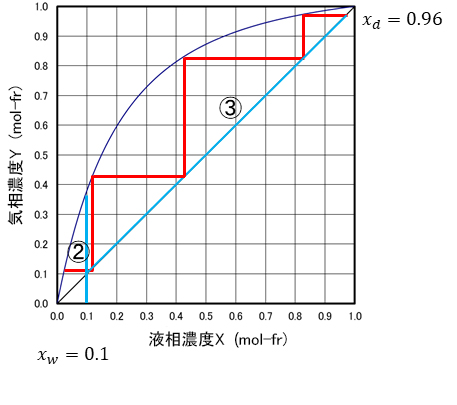
�}-20�ł͑�����̌X����1�ł��B�S�җ��ł��B��������̔��o�ʂ�0�ł��B���̂Ƃ����_�i���ŏ��ƂȂ邱�Ƃ��킩��܂��B���̂悤�ɑS�җ���Ԃł̗��_�i�����u�ŏ����_�i���v�Ƃ����܂��B
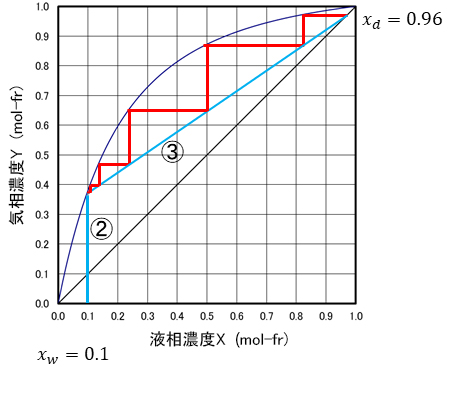
�}-21�ł́A�A�̐��ƇB�̑�������C�t���t����Ō������Ă��܂��B���̂Ƃ��A�}�̂悤�ɓ����ڕW�l����K�i��}���s���Ɩ�����̒i�����K�v�ł��B�����āA���̂Ƃ��A������̌X���͍ŏ��ƂȂ�܂��B���̂悤�Ȋҗ�����u�ŏ��җ����v�Ƃ����܂��B
�ł́A�ǂ̂悤�Ȋҗ���Ɨ��_�i���ɂȂ鑀��������������̂ł��傤���H
�җ���𑽂�����A���_�i���͏��Ȃ��čς݂܂����A���a�������Ȃ蓃��̐����グ�ʂ������܂��B�җ��������������Η��_�i���͑����������̓����������Ȃ�܂��B���A�ȃG�l�ƂȂ�܂��B���̑I���́A�v���̏�����ɂ��܂��B��ʓI�ɂ́A�ŏ��җ����1.5�{�O��Ƃ����Ă��܂��B �������A�d�v�Ȃ��Ƃ�Y��Ă͂����܂���B�u����������v�̉���ł��B���́A�B�̑�����͒����ł͂Ȃ��̂ł��B�u����������v�̉��� �� �������M���������B�e�i�̉��x���������B�����M���Ȃ��B�ȂǁA��_�ȉ���̂��Ƃɑ�����������ƂȂ��Ă��܂��B�܂�A�������x�ƃG���^���s�[���x���l�����ꂽ������Ƃ��Ȃ���Ȃ�܂���B���̉�@�̓|���`�����E�T�o���Ƃ���}��@������܂����ʂ̋@��Ƃ��܂��B
�Z�p��� - �����Ƃ��R���e���c
- �����Ƃ́i�O�����j
- ���C��
- �����Ŏg�p����Z�x�̒P��
- �C�̂ƈ���
- �P�ꐬ���t�̂̏��C��
- ���z�n�t�Ƃ�
- �����n�t�̏��C��(�C�t���t)
- �P�����ƕ������x�i�A�������j
- �����̌����Ə������u
- �����Ƃ́i�܂Ƃ߁j







