HOME >> 技術情報 >> 蒸留とは - 混合溶液の蒸気圧(気液平衡)
混合溶液の蒸気圧(気液平衡)
混合溶液の蒸気圧(気液平衡)
混合溶液の蒸気圧は、単一成分の蒸気圧式「アントン式」および「ラウールの法則」と「ドルトンの分圧の法則」との組み合わせから求まります。理想溶液では、この3式と物質収支式にて、蒸留計算(蒸留シミュレーション)のすべてができてしまいます。
復習が長くなりましたが、ここからが「蒸留とは」の本題です。液体と気体の振る舞い方のイメージをどんどん膨らませてください。 蒸留の基本が手に取るように理解できてくると思います。
純粋成分の温度によって決まる蒸気圧も、気体と液体が平衡状態にあるときの値です。平衡状態とは、同じ状態に長く保たれたとき、圧力も濃度も変化しなくなった状態のことをいいます。このとき、分子の動きが静止したのではなく、激しく運動しつつも気体になる分子の数と液体になる分子の数が等しくなっています。
二成分系の気液平衡を求めてみましょう。
液相が温度、濃度、とすると、ラウールの法則、ドルトンの分圧の法則よりそれぞれの気相の濃度は、
各成分の分圧は、ラウールの法則(12)式より求める。 全圧は各分圧の和(ドルトンの法則) よって、各成分の気相濃度() は、
それぞれの純粋成分の蒸気圧は、 にて求める。
全圧がで、濃度、であるときは、直接は求まらないので、温度を仮定して (16) 式中のとなるようなを見つける操作が必要となる。
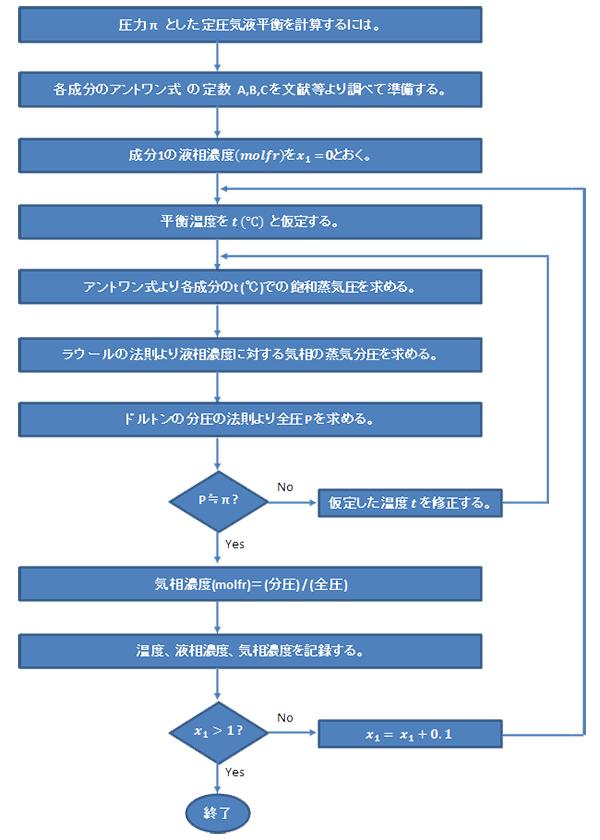
気液平衡線図の作成(X-Y線図)
計算結果を下図のごとくプロットする。
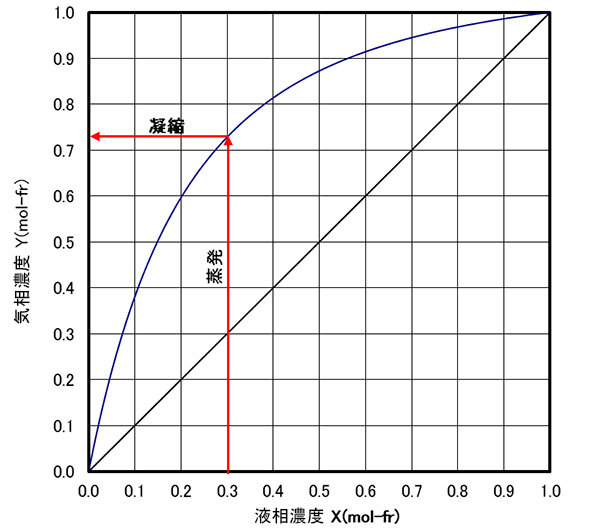
図-3は、定圧として計算された気液平衡濃度の結果である。 気液平衡線図は、横軸に軽沸成分の液濃度()、縦軸に軽沸成分の気相濃度()とするのが一般的である。この図より、たとえば液相濃度の液を蒸発させて、発生した蒸気を凝縮させると、まで濃縮された液となることを示している。
沸点曲線、露点曲線
液相-気相間の気液平衡関係と沸点の関係を同時に示したグラフが、図-4 である。この図は、横軸におよびをとり縦軸に温度()をとった図であり、、 をプロットしている。図-3と同じく、に対してその平衡温度は、であることを示している。
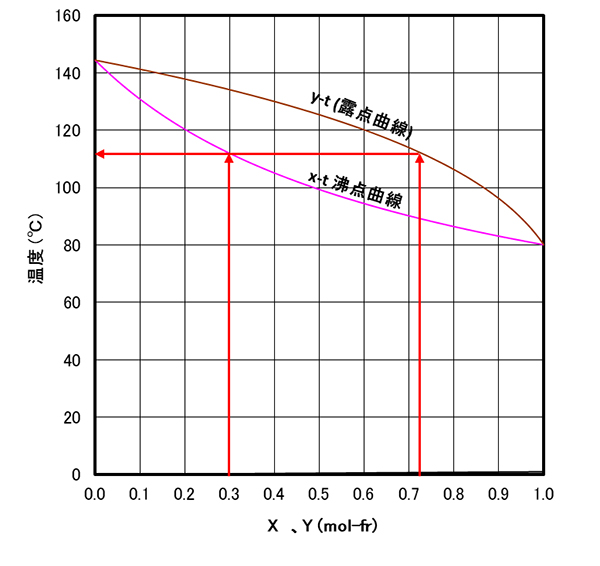
なお図-4は、液相領域、気液混合領域、気相領域をも示している。







